PROYECTOS DE INVESTIGACIÓN CON CPASS
¿Qué es cPass y cómo funciona?
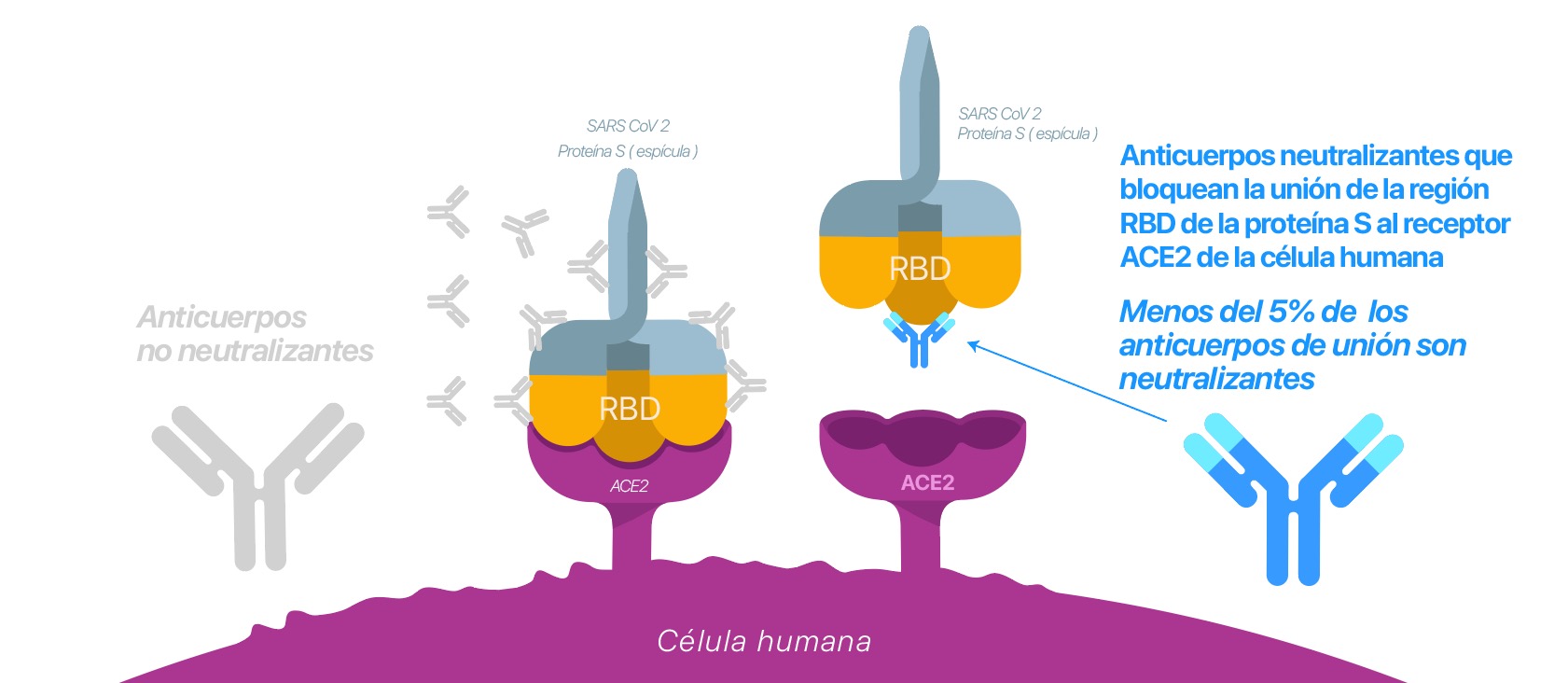
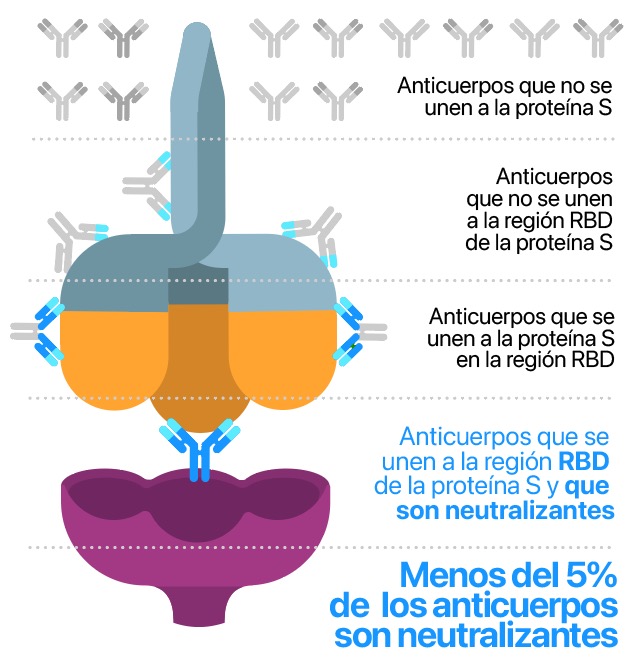
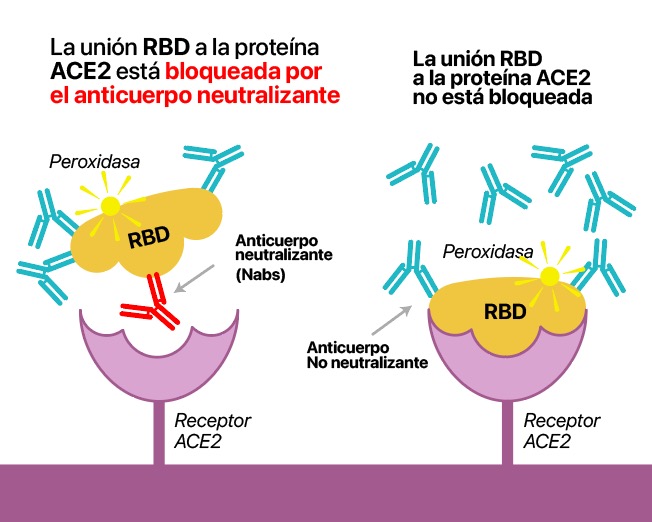
Es un test ELISA de neutralización subrogado capaz de detectar el nivel de anticuerpos neutralizantes específicos contra la unión RBD-ACE2 presentes en el suero humano de personas infectadas y/o vacunadas.
Esa unión es imprescindible para que exista infección por tanto si detectamos su bloqueo detectamos la presencia de anticuerpos que de verdad impiden el contagio y no solo cualquiera que genere el organismo.
Si hay AcN en la muestra, estos se unirán al dominio RBD conjugado a la enzima peroxidasa (HRP). Con los AcN neutralizando el RBD-HRP, éste no interaccionará con los ACE2 de la microplaca.
Si no hay AcN, el RBD-HRP estará disponible para interaccionar con ACE2. Tras los procesos de lavado y de revelado, se detectará la señal colorimétrica proveniente de cada pocillo en función de la cantidad del complejo RBD-HRP-ACE2 formado. Por tanto, la relación entre el nivel de AcN y la señal detectada es inversamente proporcional.
A mayor cantidad de AcN, menor RBD-HRP presente y, por tanto, menor señal. (2,3,4). cPassTM Permite cuantificar esta relación mediante el uso de una curva patrón (ver gráfica)
escenario 1
Cuando cPass no detecta anticuerpos neutralizantes (aunque si puede haber presencia de anticuerpos no válidos) y en consecuencia no hay inmunidad protectora
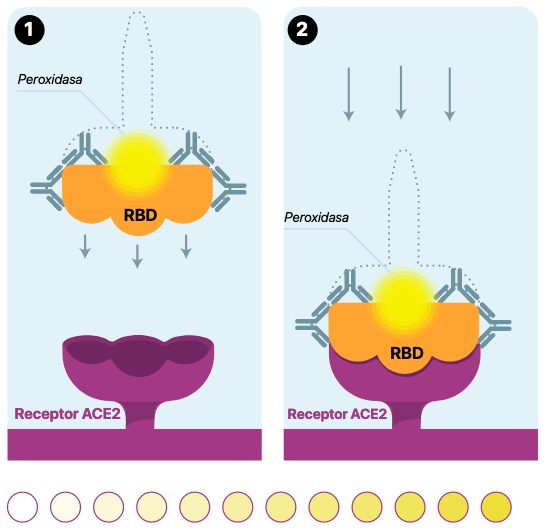
Si no hay Anticuerpos neutralizantes ( puede haber de otro tipo) , el RBD-HRP estará disponible para interaccionar con ACE2.
Tras los procesos de lavado y de revelado, se detectará la señal colorimétrica proveniente de cada pocillo en función de la cantidad del complejo RBD-HRP-ACE2 formado.
escenario 2
Cuando cPass detecta anticuerpos neutralizantes y en consecuencia hay inmunidad protectora
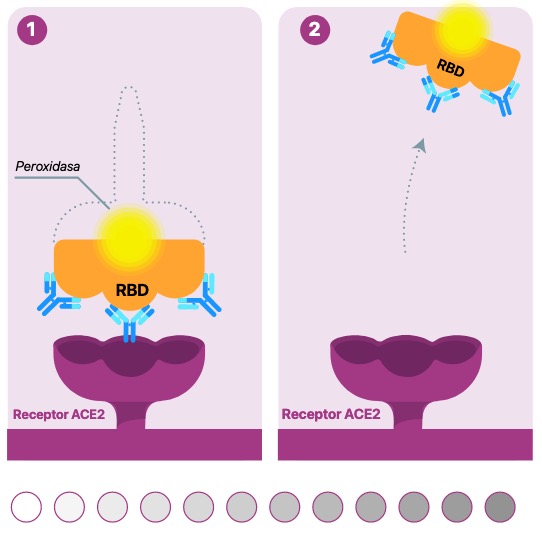
Si no hay Anticuerpos neutralizantes ( puede haber de otro tipo) , el RBD-HRP estará disponible para interaccionar con ACE2.
Tras los procesos de lavado y de revelado, se detectará la señal colorimétrica proveniente de cada pocillo en función de la cantidad del complejo RBD-HRP-ACE2 formado.